Задание № 794 
Сложность: III
Расчетные задачи в неорганической химии
i
Сгорание водорода и аммиака протекает согласно термохимическим уравнениям:
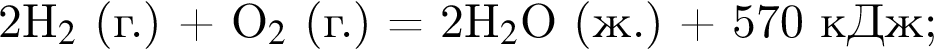
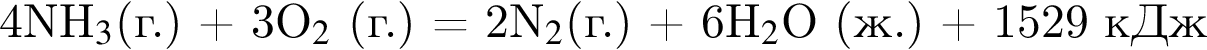
Рассчитайте количество теплоты (кДж), которое выделится при сгорании смеси водорода и аммиака массой 5,52 г, взятых в мольном отношении 3 : 1 соответственно.
Решение. М(смеси) = М1N1 + M2N2 + ...
где N — мольные доли газа
М(смеси) = 2 · 0,75 + 17 · 0,25 = 5,75 г/моль
n=m/M
n(смеси) = 5,52/5,75 = 0,96 моль
Так как водород и аммиак в смеси находятся в отношении 3:1
n(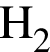 ) = 0,72 моль
) = 0,72 моль
n( ) = 0,4 моль
) = 0,4 моль
На основании термохимического уравнения 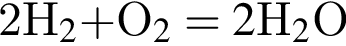 +570кДж
+570кДж
на 2 моль 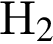 выделяется 570 кДж
выделяется 570 кДж
на 0,72 моль — х
Откуда х = 205.2 кДж
На основании термохимического уравнения 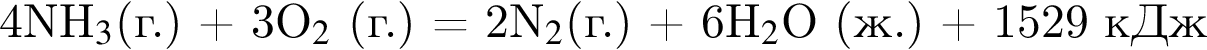
на 4 моль  выделяется 1529 кДж
выделяется 1529 кДж
на 0,24 моль — у
Откуда у = 91.74 кДж
Следовательно, общее количество выделяющейся теплоты
Q = 205.2 + 91.74 = 297 кДж
Ответ: 297
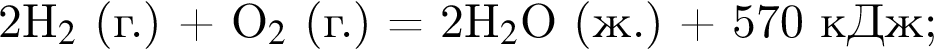
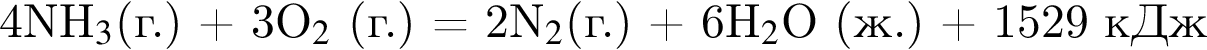

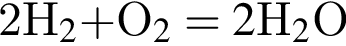 +570кДж
+570кДж